在解决超纯水的pH测量问题前,我们应该先了解超纯水的理论pH值应该是多少。
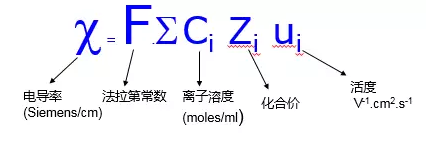

所以说超纯水的理论pH为7,那我们平时为何测量超纯水时常常呈现酸性??
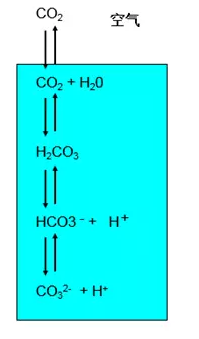

由于超纯水和空气接触,空气中的二氧化碳进入到超纯水中,导致pH数值降低,呈现酸性。
为何不能用常规pH计测量超纯水的pH??
由于超纯水没有任何缓冲能力(即在溶解其他物质的同时仍保持自身的pH值),因此微小的污染也会改变其pH值。同时纯水是一种优良的绝缘体,因此在测量pH时很难让pH计的测量电极和参比电极之间导通。这样在测量用的电极电路中,产生极高的电阻会使得测量的电信号噪声变大,电极的反应变慢,并产生静电双电层(static buildup)。产生的电场会使测量得到的电阻比实际值要大,这样测量得到的pH数值是错误的。
常规pH计测量超纯水不准确的原因??
CO2的影响:CO2溶入水中在水中形成H2CO3碳酸是2元弱酸在水中电离。影响pH的主要是HCO3-离子HCO3-电离显示酸性,水解显示碱性。因为反应是可逆的导致pH值不断变化。国标规定测量必须在一个特殊的装置中密闭中进行。
由于纯水中离子浓度非常低,而参比电极盐桥溶液选的是中高浓度3mol/L的KCl,相互之间的浓度差较大,与它在普通溶液中的情况差别很大。在纯水中会加大盐桥溶液的渗透速度促使盐桥的损耗从而加速了K+和Cl-的浓度的降低。引起液接界电位的变化和不稳定,而Ag/AgCl参比电极本身的电位取决于Cl-的浓度。Cl-浓度发生了变化其参比电极自身电位也会随之变化。于是就使得示值漂移。特别是不能补充内参比液的复合电极更会如此。
由于纯水是一种无缓冲作用的液体,与标准缓冲溶液的性质完全不同,在标准缓冲溶液中表现良好的电极一下子移至无缓冲性的纯水中电极电位的建立时间无疑就会变得迟缓。
静电干扰:由于超纯水的传导性非常差,所以它也是一个静电源。这些静电可以在测量pH值时表现出来。为了补偿这些干扰电极要做特别的屏蔽。这种电极相对来说比较贵特别为超纯水的pH测量做出特殊的设计。
温度的影响:不同温度下水的离子积是不同的在25℃为7,100℃为6.14;这个和测量别的溶液时的影响相同。
那么如何解决超纯水pH的测量问题??
选择适合的pH计,测量超纯水的pH需要特殊的电极,此电极接一个金属的、接地的附件。通过接地增大了整个电路的电容从而降低了电信号噪声,同时由于接地分流了电荷使得测量信号的稳定时间增大,也在某种程度上降低了静电双电层的强度。

瑞士梅特勒INInLabPurePro三合一超纯水pH电极
加大被测纯水的取样量,并可能减小和空气的接触面,同时不要搅拌和摇动以减少CO2的吸收,有密闭的容器好。
被测水样中加入中性盐(如KCl),作为离子强度调节剂,改变溶液中的离子总强度增加导电性使测量快速稳定。此方法国家标准GB/T6P04.3-93中规定“测量水样时为了减少液接电位的影响和快速达到稳定,每50ml水样中加入一滴中性0.1moL/L KCl溶液”。(KCl试剂要采用高纯度的,所配溶液的水质也要高纯度的中性水质。)
使用电阻率计测量超纯水的电阻率,25℃超纯水的pH为18.2 Mcm 。